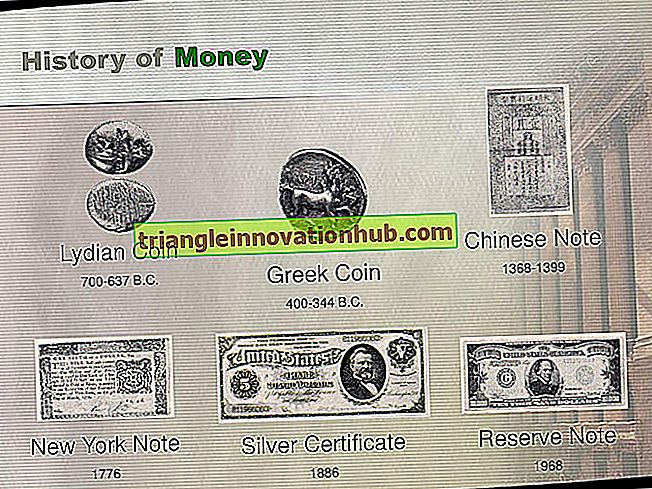
Sporenfärbung von Bakterien zur Differenzierung der bakteriellen Spore und der vegetativen Zelle
Zweck:
Alle Bakterien bleiben in ihrer "vegetativen Form", wenn die Umweltbedingungen für ihre normalen Stoffwechselaktivitäten günstig sind.
In dieser Form nehmen sie Nährstoffe auf, wachsen und vermehren sich.
Auf der anderen Seite sterben die meisten von ihnen, wenn die Umweltbedingungen nachteilig werden, wie starke Kälte, extreme Hitze, Alterung, Nährstoffmangel, Strahlenbelastung und giftige Chemikalien.
Nur wenige Arten von Bakterien können unter solchen widrigen Bedingungen überleben, indem sie sich in hochresistente, metabolisch inaktive Formen umwandeln, die als "Sporen" bezeichnet werden. Bei widrigen Bedingungen wird eine Spore in einer vegetativen Zelle durch Dehydratisierung und Kontraktion des Zellinhalts erzeugt.
Diese in der Bakterienzelle gebildete Spore wird als "Endospor" bezeichnet (Abbildung 2.13). Wenn sich ungünstige Bedingungen verschlechtern, bricht die Zelle und setzt den Endospor frei, der jetzt zu einer unabhängigen, ruhenden Zelle namens "Spore" wird.
Der Prozess der Sporenbildung wird als "Sporogenese" bezeichnet. Die Spore besteht aus dicken, relativ undurchlässigen Schichten wie Sporenrinde und Sporenmantel, die die Zelle vor physischen Schäden schützen. Die Spore erlangt ihren Widerstand durch mehrere Mechanismen, die noch nicht klar erklärt wurden.
Wenn die Bedingungen günstig sind, bilden die Schichten, die den Sporenbruch bedecken, und die Spore führt zu einer metabolisch aktiven vegetativen Zelle. Dieser Vorgang wird als "Keimung" bezeichnet.
Aufgrund der Fähigkeit, Sporen zu bilden, können Bakterien wie folgt in zwei Gruppen unterteilt werden:
(1) Sporenbildende Bakterien (Sporenbildner):
Bakterien, die eine Spore produzieren können, um unter widrigen Umweltbedingungen zu überleben, sind Sporen bildende Bakterien (Sporenbildner). Meist können die folgenden drei Gattungen stäbchenförmiger Bakterien unter widrigen Umgebungsbedingungen Sporen erzeugen.
A. Aerobe stäbchenförmige Bakterien
1. Bacillus spp.
B. anaerobe stäbchenförmige Bakterien
2. Clostridium spp.
3. Desulfotomaculum spp.
(2) nicht sporenbildende Bakterien (Nicht-Sporenbildner):
Ein Bakterium, das keine Spore produzieren kann und daher unter widrigen Umweltbedingungen in seiner vegetativen Form stirbt, ist ein nicht sporenbildendes Bakterium (kein Sporenbildner).
Der Zweck der Sporenfärbung besteht darin, die Sporen und vegetativen Zellen eines Sporenbildners zu unterscheiden und Sporenbildner von Nicht-Sporenbildnern zu unterscheiden. Die Sporenfärbung ist auch hilfreich bei der Identifizierung der Bakterien der Gattungen Bacillus, Clostridium und Desulfotomaculum.
Prinzip:
Die Sporen unterscheiden sich von den vegetativen Zellen dadurch, dass sie dicke, relativ undurchlässige Schichten um sich herum haben (Abbildung 2.14). Der Primärfleck Malachitgrün kann durch diese Schichten nicht in die Sporen eindringen.
Daher wird das Eindringen des Primärflecks durch die Anwendung von Wärme verstärkt, die es durch die Deckschichten in den Sporenprotoplasten treibt. Jetzt erscheinen die Sporen grün. Wenn die Sporen mit dem Entfärbungsmittel (Leitungswasser) behandelt werden, werden sie nicht entfärbt, da sie kein Wasser enthalten.
Das Leitungswasser entfernt nur den überschüssigen Primärfleck in der Umgebung der Sporen. Somit behalten die Sporen die grüne Farbe. Bei einer Gegenfärbung mit Safranin können die Safraninmoleküle anschließend nicht durch die Deckschichten in die Sporen gelangen. So behalten die Sporen schließlich die grüne Farbe des Primärflecks und erscheinen grün.

Andererseits nehmen die vegetativen Bakterienzellen den Primärfleck Malachitgrün leicht auf, aber der Fleck hat keine starke Affinität für vegetative Zellbestandteile, weshalb er weggespült wird, wenn er unter Leitungswasser entfärbt wird.
Nun erscheinen die vegetativen Zellen farblos. Bei einer Gegenfärbung mit Safranin nehmen die farblosen vegetativen Zellen den Fleck auf und erscheinen im Gegensatz zu den grünen Sporen rot.
Erforderliche Materialien:
Objektträger, Schlaufe, Malachitgrün, Safranin, sporenbildende Bakterien, heiße Platte, Mikroskop, Immersionsöl.
Verfahren:
1. Ein Objektträger wird ordnungsgemäß unter Leitungswasser gereinigt, so dass Wasser nicht als Tropfen auf seiner Oberfläche verbleibt.
2. Das anhaftende Wasser wird mit Lappenpapier abgewischt und der Objektträger an der Luft getrocknet.
3. Ein Abstrich sporenbildender Bakterien wird in der Mitte eines Objektträgers in zwei unten beschriebenen Verfahren hergestellt.
(ein) Wenn Sporenbildner, die auf einer Agarplatte oder einer Agarschräge gezüchtet werden, zu beobachten sind, wird ein Wassertropfen in die Mitte des Objektträgers gesetzt. Eine Schleife wird über der Flamme sterilisiert und eine Clostridiumschleife von Bakterien aus einer gealterten Platte oder einer geneigten Kultur (48 bis 72 Stunden) des Sporenbildners, wie Clostridium Supergenes oder Bacillus subtilis, wird auf den Wassertropfen übertragen.
Dann wird durch sanfte Rotation der Schleife im Wassertropfen eine Bakteriensuspension hergestellt und der Tropfen verteilt, bis ein Abstrich erhalten wird. Mit zunehmendem Alter sporenbildender Bakterien auf Platten- oder Schrägkulturen bilden sie Sporen.
(b) Wenn Sporenbildner, die in flüssiger Brühe gezüchtet werden, beobachtet werden sollen, wird die nur vegetative Zellen enthaltende Brühkultur durch 15minütiges Erhitzen in einem Wasserbad Hitzestress ausgesetzt, so dass einige der vegetativen Zellen zur Überwindung der Sporen Sporen bilden Hitzestress. Ein Tropfen der gemischten sporenvegetativen Zellsuspension aus der Kulturbrühe wird durch eine sterile Schleife direkt in die Mitte des Objektträgers gegeben und ein Abstrich wird durch Ausbreiten hergestellt.
4. Der Abstrich wird luftgetrocknet.
5. Der Abstrich wird durch Erhitzen fixiert. Das Erhitzen führt zu einer Koagulation der zellulären Proteine, wodurch die Zellen an der Oberfläche des Objektträgers haften bleiben und während des Färbens nicht weggespült werden. Die Wärmefixierung erfolgt durch schnelles Durchführen des Objektträgers über eine Flamme 2-3 Mal mit dem Abstrich Oberfläche nach oben, damit der Abstrich nicht erhitzt wird.
6. Der Abstrich wird mit Malachitgrün, dem Hauptfleck, überflutet.
7. Der Objektträger wird auf einer warmen heißen Platte aufbewahrt und die Zubereitung 2-3 Minuten lang gedämpft. Die Temperatur der Heizplatte ist so eingestellt, dass die Zubereitung nicht siedet und schnell verdampft. Der Verdampfungsverlust wird wieder aufgefüllt, damit der Abstrich nicht austrocknet.
8. Der Objektträger wird von der heißen Platte entfernt und abgekühlt.
9. Der Abstrich wird durch Waschen unter fließendem Leitungswasser so entfärbt, dass Wasser nicht direkt auf den Abstrich fällt.
10. Der Abstrich wird 30 Sekunden lang mit dem Gegenfleck Safranin geflutet.
11. Überschüssiger Gegenfleck wird unter sanft fließendem Leitungswasser vollständig aus dem Abstrich weggespült, so dass Wasser nicht direkt auf den Abstrich fällt.
12. Die Folie wird mit Lappenpapier trockengesaugt.
13. Der Objektträger wird auf die Bühne des Mikroskops geklemmt und der Abstrich bei niedriger Leistung und hohen trockenen Objektiven beobachtet.
14. Ein Tropfen Immersionsöl wird auf den Abstrich aufgetragen.
15. Der Abstrich wird unter Ölimmersionsobjektiv beobachtet.
Beobachtungen (Unter Ölimmersionsobjektiv):
1. Farbe der Zellen:
Grün: Spore (Beachten Sie die Position der Spore)
Rot: Vegetationszelle
2. Form der Bakterien:
Kugelförmig (Coccus)
Stäbchen (Bazillen)
Kommaähnlich (Vibrio)
Spirale (Spirochäten)
3. Anordnung von Bakterien:
Paare (Diplobacillus / Diplococcus)
In Vieren (Tetraden)
In Ketten (Streptococcus / Streptobacillus)
Traubenartige Haufen (Staphylococcus)
Cuboidal (Sarkinae oder Oktett)
4. Größe der Bakterien:
Nach Augenschätzung zeichnen Sie das Feld unter dem Ölimmersionsobjektiv.