5 Arten von Leukozyten (weiße Blutkörperchen)
Leukozyten oder weiße Blutkörperchen sind die wichtigen Zellen, die an vielen Abwehrfunktionen beteiligt sind. Sie werden aus den hämatopoetischen Stammzellen im Knochenmark produziert.
Es gibt verschiedene Leukozyten mit unterschiedlicher Morphologie und Funktion. Die Gesamtzahl der Leukozyten und der Prozentsatz verschiedener Leukozyten im menschlichen peripheren Blut sind in Tabelle 4.1 angegeben. Es gibt verschiedene Arten von Leukozyten:
1. Lymphozyten
Lymphozyten entstehen aus den hämatopoetischen Stammzellen im Knochenmark. Der normale erwachsene Mensch hat etwa Billionen (10 12 ) Lymphozyten. Lymphozyten sind kleine, runde (5-12 Mikrometer Durchmesser) Zellen mit einem Zellkern, der fast die gesamte Zelle einnimmt, und hinterlässt ein spärliches Zytoplasma.
Tabelle 4.1: Anzahl der peripheren venösen Blutleukozyten:
Zellen × 10 3 / μl | Prozent | Absolute Anzahl x 10 9 | |
Gesamtzahl der Leukozyten | |||
Erwachsene | 4-11 | 4-11 | |
Kleinkinder (Vollzeit bei der Geburt) | 10-25 | 10-25 | |
Kleinkinder (1 Jahr) | 6-18 | 6-18 | |
Kindheit (4-7 Jahre) | 5-15 | 5-15 | |
Kindheit (8-12 Jahre) | 4, 5-13, 5 | 4, 5-13, 5 | |
Differenzielle Leukozytenzahl bei Erwachsenen | |||
Neutrophile | 40-75 | 2, 0-7, 5 | |
Lymphozyten | 20-50 | 1, 5-4, 0 | |
Monozyten | 2-10 | 0, 2-0, 8 | |
Eosinophile | 1-6 | 0, 04-0, 4 | |
Basophile | <1 | 0, 01-0, 1 |
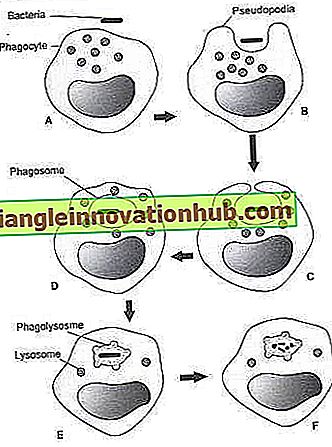
Abb. 4.3A bis F: Phagozytose und Abbau von Materie (z. B. Bakterien). (A) Phagozyten und Bakterien. (B) Der Phagozyt ragt seine Pseudopodien um die Bakterien herum. (C und D) Die Pseudopodien umgeben die Bakterien. Nach dem Umkreisen der Bakterien verschmelzen die Pseudopodien und bilden eine Membranvakuole. Die häutige Vakuole wird als Phagosom bezeichnet.
Die Bakterien liegen im Phagosom. (E) Die lysosomalen Membranen des Phagozyten verschmelzen mit der phagosomalen Membran und bilden ein Phagolysosom. Der lysosomale Inhalt wird über die Bakterien abgegeben. (F) Der lysosomale Gehalt Inaktiviert und baut die Bakterien ab.
Fast alle Lymphozyten sehen sich unter dem Mikroskop ähnlich. Aufgrund ihrer funktionellen Eigenschaften und der Anwesenheit spezifischer Proteinmoleküle auf ihrer Zelloberfläche werden die Lymphozyten in mehrere Populationen unterteilt:
ich. B-Lymphozyten
ii. T-Lymphozyten
iii. Natürliche Killerzellen (NK)
Tabelle 4.2: Prozentsatz (ungefähr) von Lymphzellen in normalen menschlichen Geweben:
Gewebe | T-Lymphozyten | B-Lymphozyten | NK-Zellen |
Peripheren Blut | 70-80 | 10-15 | 10-15 |
Knochenmark | 5-10 | 80-90 | 5-10 |
Thymusdrüse | 99 | <1 | <1 |
Lymphknoten | 70-80 | 20-30 | <1 |
Milz | 30-40 | 50-60 | 1-5 |
Die relativen Anteile von T- und B-Zellen im peripheren Blut betragen etwa 75 bzw. 10 Prozent aller Lymphozyten. (Der Anteil variiert in verschiedenen Geweben). Die restlichen 15 Prozent der peripheren Blutlymphozyten sind NK-Zellen (Tabelle 4.2).
Sowohl T- als auch B-Zellen entstehen aus hämatopoetischen Stammzellen im Knochenmark eines Erwachsenen oder der Leber des Fötus. Die Entwicklung der B-Lymphozyten findet vollständig im Knochenmark statt und sie lassen das Knochenmark als reife B-Zellen in den Blutkreislauf. Während die T-Zellen im Knochenmark keine volle Reife erreichen. Unreife T-Zellen aus dem Knochenmark gelangen in den Blutkreislauf und erreichen ein Organ namens Thymus. Im Thymus entwickeln sich die unreifen T-Lymphozyten (auch Vorläufer-T-Lymphozyten genannt) weiter und überlassen den Thymus als reife T-Lymphozyten dem Kreislauf (Abb. 4.4).
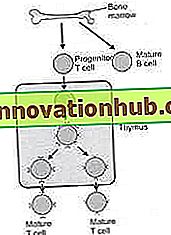
Abb. 4.4: Entwicklung von T-Lymphozyten und B-Lymphozyten.
Bei einem Erwachsenen werden T-Lymphozyten und B-Lymphozyten aus den hämatopoetischen Stammzellen im Knochenmark produziert. Die gesamte Entwicklung von B-Zellen findet im Knochenmark statt und folglich sind die aus dem Knochenmark freigesetzten B-Zellen reife B-Zellen. Die Entwicklung von T-Lymphozyten ist dagegen im Knochenmark nicht abgeschlossen. Aus dem Knochenmark freigesetzte T-Zellen sind unreif und werden Vorläufer-T-Lymphozyten genannt. Die Vorläufer-T-Zellen gelangen in ein Organ namens Thymusdrüse. Eine weitere Reifung der T-Zellen findet in der Thymusdrüse statt und reife T-Zellen werden aus der Thymusdrüse in den Kreislauf freigesetzt
Die reifen Lymphozyten, die in den Blutkreislauf gelangen, werden Jungfraulymphozyten genannt. Jungfrau-Lymphozyten befinden sich im "Ruhezustand" oder "Ruhezustand" und teilen sich nicht. Jungfrau-Lymphozyten haben nur wenige Tage im Leben. Wenn der jungfräuliche Lymphozyt nicht mit seinem spezifischen Antigen in Kontakt kommt, stirbt der Lymphozyt innerhalb weniger Tage. Wenn der ruhende Lymphozyt dagegen mit seinem spezifischen Antigen in Kontakt kommt, wird der Lymphozyt aktiviert. (Ein Antigen wird im Allgemeinen als Fremdsubstanz beschrieben, die im Wirt Immunreaktionen auslösen kann).
Im Gegensatz zu den ruhenden Lymphozyten stirbt der aktivierte Lymphozyt nicht in wenigen Tagen. Der aktivierte Lymphozyt durchläuft mehrere Tage lang mehrere aufeinanderfolgende Runden der Zellteilung. Einige der geteilten Lymphozyten werden zu Effektorlymphozyten und die restlichen Zellen werden zu Gedächtnislymphozyten (Abb. 4.5).
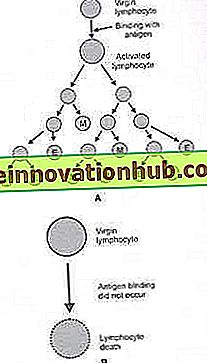
Abb. 4.5A und B: Lymphozytenaktivierung. Reife T-Lymphozyten und B-Lymphozyten, die von Thymus und Knochenmark in den Blutkreislauf gelangen, befinden sich in einem Ruhezustand oder im jungfräulichen Zustand. (A) Der Kontakt eines ruhenden Lymphozyten mit seinem spezifischen Antigen führt zur Aktivierung des Lymphozyten. Der aktivierte Lymphozyt durchläuft mehrere Teilungsrunden.
Nach jeder Teilung können sich die Tochterzellen weiter teilen oder die Tochterzellen können die weitere Teilung stoppen und in Gedächtnis (M) -Lymphozyten oder Effektor (E) -Lymphozyten differenzieren. (B) Der ruhende Lymphozyt, der das spezifische Antigen nicht kontaktiert, stirbt innerhalb weniger Tage nach Eintritt in den Kreislauf
ich. Effektor-Lymphozyten leben einige Tage bis wenige Wochen und führen spezifische Abwehraktivitäten gegen das Antigen aus.
ii. Die Gedächtnislymphozyten hingegen kehren in den Ruhezustand zurück und überleben viele Monate bis Jahre. Wenn anschließend die Speicherzelle mit dem spezifischen Antigen in Kontakt kommt, wird die Speicherzelle aktiviert. Aktivierte Speicherzellen teilen sich und ihre Funktionen führen zur Eliminierung des Antigens. Gedächtnislymphozyten machen einen großen Teil der Lymphozyten im Erwachsenen aus.
B Lymphozyten:
Bei Vögeln tritt die Entwicklung von B-Lymphozyten in einem speziellen Organ auf, der Bursa von Fabricius, die sich in der Nähe der Cloacae befindet. Der B-Lymphozyt hat seine Buchstabenbezeichnung von seinem Reifungsort bei Vögeln, der Schleimbeutel des Fabricius, abgeleitet. Übrigens wird der Name B zutreffend, da im Menschen die Zellentwicklung und -reifung der Zelle im Knochenmark erfolgt.
Erworbene Immunität wird mit zwei Armen beschrieben, der humoralen Immunität und der zellvermittelten Immunität. B-Zellen sind die wichtigsten Zelltypen, die an der humoralen Immunität beteiligt sind. B-Zellen entstehen aus den hämatopoetischen Stammzellen im Knochenmark.
Reife B-Zellen aus dem in den Blutkreislauf gelangenden Knochenmark werden als ruhende (oder reine) B-Zellen bezeichnet. Die ruhenden B-Zellen scheiden kein Immunglobulin aus. Die ruhenden B-Zellen exprimieren jedoch Immunglobulinmoleküle auf ihrer Zellmembran (als Oberflächen-Immunglobulin bezeichnet) (Abb. 4.7).
Die Oberflächenimmunoglobuline dienen als Antigenrezeptoren für B-Zellen. Jede B-Zelle exprimiert Zehntausende solcher Antigenrezeptoren auf ihrer Oberfläche. Alle Oberflächen-Immunglobuline einer einzigen B-Zelle binden an einen Antigen-Typ (dh eine B-Zelle ist für ein bestimmtes Antigen spezifisch).
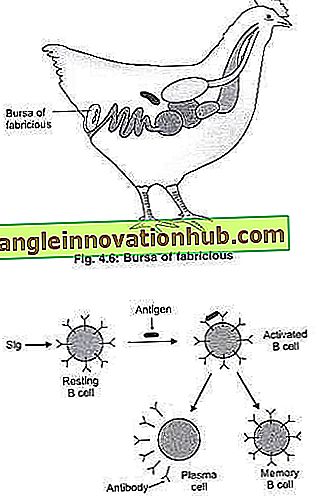
Abb. 4.7: B-Zelloberflächen-Immunglobuline (Sigs) und sekretierte Immunglobuline (Antikörper).
Ruhende B-Zellen exprimieren zahlreiche Oberflächen-Immunglobulin (sIg) -Moleküle auf ihrer Zellmembran. Die sIgs sind an der B-Zellmembran verankert. Die Sigs auf B-Zellen binden an das spezifische Antigen. Die Bindung des Antigens mit den sIgs führt zur Aktivierung der B-Zelle. Bei Aktivierung teilen sich die aktivierten B-Zellen, um Effektor-B-Zellen (auch Plasmazellen genannt) und Speicher-B-Zellen herzustellen. Die Plasmazellen sekretieren das Immunglobulin. Die ausgeschiedenen Immunglobulins werden als Antikörper bezeichnet
Wenn das Antigen an den Oberflächen-Immunglobulinrezeptor an einer ruhenden B-Zelle bindet, werden Signale innerhalb der B-Zelle gesendet und die nachfolgenden Ereignisse führen zu einer Aktivierung der B-Zelle. Aktivierte B-Zellen werden größer und teilen sich. Einige der geteilten Zellen werden zu Effektor-B-Zellen (Plasmazellen genannt) und der Rest zu Speicher-B-Zellen.
Die Plasmazellen (Effektor-Nachkommen der aktivierten B-Zelle) scheiden große Mengen von Immunglobulinen aus, die als Antikörper bezeichnet werden. Die Antikörper binden an ihre spezifischen Antigene und führen zur Abspaltung der Antigene. Plasmazellen sind ovale oder eiförmige Zellen mit reichlich vorhandenem Zytoplasma. Normalerweise exprimieren Plasmazellen kein Oberflächen-Immunglobulin, sondern sie scheiden große Mengen an Immunglobulin aus. Plasmazellen teilen sich nicht weiter und sterben normalerweise innerhalb weniger Tage bis Wochen.
Der von einer Plasmazelle sezernierte Antikörper bindet nur an das Antigen, das die B-Zelle (aus der die Plasmazelle hergestellt wurde) aktivierte, und dies wird als Spezifität des Antikörpers bezeichnet. Solange das Antigen im Körper verbleibt, werden neue Plasmazellen hergestellt. Folglich steigt die Antikörpermenge im Blut. (Bei chronischen Infektionen wie Lepra und Tuberkulose sind aufgrund der längeren Präsenz dieser Bakterien im Körper große Mengen von Antikörpern im Blut vorhanden). Nach der Abspaltung des Antigens hört die Produktion von Plasmazellen langsam auf und folglich nimmt auch die Menge an Antikörpern mit der Zeit ab.
T Lymphozyten:
T-Lymphozyten entstehen aus den hämatopoetischen Stammzellen im Knochenmark. Die T-Zellen, die aus dem Knochenmark in den Blutkreislauf gelangen, sind unreif und werden Vorläufer-T-Zellen genannt. Die unreifen T-Zellen dringen in ein Organ namens Thymus ein. Die weitere Reifung der T-Zellen erfolgt im Thymus. Später werden reife T-Zellen aus der Thymusdrüse in den Blutkreislauf freigesetzt. (Aber B-Zellen, die aus dem Knochenmark in den Blutkreislauf freigesetzt werden, sind in reifer Form).
T-Zellen spielen eine wichtige Rolle bei den erworbenen Immunreaktionen. Zusammen mit Makrophagen sind die T-Zellen an einer Kategorie erworbener Immunreaktionen beteiligt, die als zellvermittelte Immunität (CMI) bezeichnet wird. T-Zellen helfen, damit die B-Zelle Antikörper produziert. Daher sind T-Zellen sowohl für zellvermittelte Immunantworten als auch für humorale Immunreaktionen erforderlich.
Der Antigenrezeptor von T-Zellen wird von einem Proteinkomplex gebildet, der als T-Zellrezeptor (TCR) bezeichnet wird und sich auf der Oberfläche von T-Zellen befindet (Abb. 4.8). Die Bindung von Antigen an TCR aktiviert die T-Zelle.

Abb. 4.8: T-Zellrezeptor.
Der T-Zell-Rezeptor (TCR) ist ein Komplex aus acht Transmembranproteinen in der T-Zellmembran. Die α- und β-Ketten des TCR binden an das Antigen. Die verbleibenden sechs Ketten werden zusammen als CD3-Komplex bezeichnet
T-Zellen scheiden kein Immunglobulin aus. Stattdessen üben die T-Zellen ihre Schutzwirkung hauptsächlich auf zwei Wegen aus (Abb. 4.9):
1. Direkter Zell-zu-Zell-Kontakt zwischen T-Zellen und anderen Zellen: Der direkte Kontakt von T-Zelloberflächenmolekülen mit Zelloberflächenmolekülen anderer Zellen beeinflusst die Aktivitäten der anderen Zelle.
2. Aktivierte T-Zellen scheiden viele Substanzen aus, die als Zytokine bezeichnet werden. Die Zytokine beeinflussen wiederum die Aktivitäten anderer Zellen. Basierend auf Funktionen und bestimmten Molekülen, die auf den Zellmembranen vorhanden sind, werden die T-Zellen in zwei Subpopulationen unterteilt, die als Helfer-T (T H ) -Zellen und zytotoxische T (T C ) -Zellen bezeichnet werden.
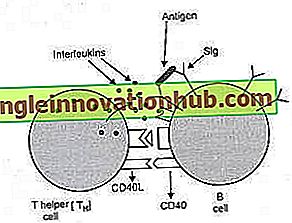
Abb. 4.9: Zwei Möglichkeiten, wie T-Zellen die Funktionen von B-Zellen beeinflussen. Schematisches Diagramm, das die zwei Wege zeigt, auf die Helfer-T (T H ) -Zellen die Aktivitäten von B-Zellen beeinflussen. Die ruhende B-Zelle wird aktiviert, wenn ihre Oberflächen-Immunglobuline (Sigs) an das Antigen gebunden werden. Neben der Antigenbindung benötigt die B-Zelle zur Aktivierung auch Hilfe von T H- Zellen. Die T H- Zelle hilft der B-Zelle auf zwei verschiedene Arten. 1. Zell-zu-Zell-Kontakt zwischen TH- Zellen und B-Zellen: Auf der Oberfläche von TH-Zellen vorhandene CD40-Liganden (CD40L) -Moleküle interagieren mit CD40-Molekülen auf der B-Zelloberfläche.
Die direkte Zell-zu-Zell-Interaktion (zwischen CD40L an T H- Zelle und CD40 an B-Zelle) ist ein Weg, durch den T H- Zelle die B-Zellaktivierung beeinflusst. 2. TH-Zellen sezernieren Interleukin-2, Interleukin-4 und Interleukin-5. Die von T H- Zellen sezernierten Interleukine binden an Interleukinrezeptoren (IL-2-Rezeptor, IL-4-Rezeptor und IL-5-Rezeptor) auf der Oberfläche von B-Zellen. Die Bindung von Interleukinen beeinflusst auch die Aktivierung der B-Zellen. Somit beeinflusst die T-Zelle die Aktivierung der B-Zellen durch die von ihr sezernierten Interleukine.
Natürliche Killerzellen:
Natural Killer (NK) -Zellen sind große granuläre Lymphozyten. NK-Zellen stammen auch von den hämatopoetischen Stammzellen im Knochenmark. Im Gegensatz zu T-Zellen benötigen NK-Zellen für ihre Reifung keinen Thymus. 15% der peripheren Blutleukozyten werden von NK-Zellen gebildet. Die NK-Zellaktivität erfordert keine vorherige Exposition gegenüber den Antigenen. Daher werden sie als "natürliche Killerzellen" bezeichnet. NK-Zellen wirken auf virusinfizierte Zellen, Krebszellen und transplantierte (z. B. Nieren-) Fremdzellen.
2. Monozyten und Makrophagen:
Der russische Biologe Elie Metchnikoff (1883) schlug zunächst die Idee vor, dass Phagozyten eine wichtige Rolle bei der Wirtsabwehr spielen. Metchnikoff nannte diese großen mononukleären Phagozyten Makrophagen. Monozyten und Makrophagen sind bewegliche Zellen und bewegen sich daher frei in Entzündungsstellen. Monozyten und Makrophagen (Abb. 4.10) sind als Reinigungszellen des Körpers bekannt, da sie Mikroben, Fremdpartikel und Ablagerungen von verletzten Stellen verschlingen und verdauen. Neben der Phagozytose spielen diese Zellen eine wichtige Rolle bei der erworbenen Immunität.

Monozyten (12-20 pim Durchmesser) sind die größte kernhaltige Zelle im Blut und stammen aus der hämatopoetischen Stammzelle im Knochenmark. Der Blutmonozyt teilt sich nicht und hat eine durchschnittliche Transitzeit von 32 Stunden im Blut. Die Monozyten kommen aus dem Blutkreislauf und befinden sich in den Geweben.
In den Geweben differenzieren sich die Monozyten und siedeln sich als funktionell aktivere Zellen an, die Gewebemakrophagen oder Histiozyten genannt werden. Makrophagen sind fünf bis zehn Mal größer als Monozyten und enthalten mehr Lysosomen. Makrophagen haben eine sehr lange Lebensdauer im Gewebe und überleben oft Monate oder sogar Jahre. Die Makrophagen in verschiedenen Geweben werden mit unterschiedlichen Namen bezeichnet (Tabelle 4.3).
Tabelle 4.3: Bezeichnung der Makrophagen:
Gewebe | Bezeichnung Zelle |
Blut Knochenmark Jedes feste Gewebe Haut Leber Lunge Knochen Synovium Zentrales Nervensystem Pleurahöhle | Monozyten Monozyten und Monozytenvorläufer (Monoblasten, Promonozyten) Residente Makrophagen (Histiozyten) Langerhans-Zellen Kupffer-Zellen Alveolarmakrophagen Osteoklasten Typ A Synovialzellen Microglia Pleuramakrophagen |
Zellen, die die Fähigkeit haben, Mikroben und andere Partikel einzubeziehen und abzubauen, werden Phagozyten genannt. Phyrozyten sind Neutrophile, Monozyten und Makrophagen. Der Prozess, bei dem die Zellen Material einschließen und das Material in einer Vakuole (Phagosom genannt) im Zytoplasma einschließen, wird Phagozytose genannt. Im Zytoplasma des Phagozyten gibt es viele membrangebundene Speichergranulate, sogenannte Lysosomen.
Innerhalb von Sekunden nach der Phagozytose verschmelzen die Membranen der Lysosomen mit der Membran des Phagosoms und bilden ein Phagolysosom. Die Körnchen in den Lysosomen werden über die Materie im Phagolysosom abgegeben. Der Prozess der Granulatabgabe über dem phagozytierten Material wird Degranulation genannt. Die körnigen Inhaltsstoffe wirken auf die Materie ein, was zur Inaktivierung und zum Abbau der Materie führt.
Makrophagenfunktionen:
1. Neben den Lymphozyten spielen die Makrophagen eine wichtige Rolle bei der erworbenen Immunität. Makrophagen sind die wichtigsten Antigen-präsentierenden Zellen (APCs) für T-Zellen.
2. Die Makrophagen werden durch Zytokine (hauptsächlich durch Interferon-Gamma), die von aktivierten T-Zellen produziert werden, "aktiviert". Die aktivierten Makrophagen haben eine größere Fähigkeit, Bakterien und Tumorzellen abzutöten. Daher spielen die Makrophagen während des gesamten Dramas der zellvermittelten Immunität viele aktive Rollen. (Makrophagen fangen die Mikroben ein, präsentieren sie T-Zellen, und schließlich töten Makrophagen selbst die Mikroben mit Hilfe von T-Zell-Cytokinen wie Interferongamma).
3. Makrophagen phagozytieren Bakterien und töten sie. Makrophagen phagozytieren Bakterien bereits beim ersten Eintritt der Bakterien in den Wirt und spielen somit eine wichtige Rolle bei der angeborenen Immunität. Makrophagen haben Rezeptoren für das Fc-Fragment von Immunglobulin und C3b, durch die sie Bakterien phagozytieren. Somit sind sie auch wichtige Phagozyten des erworbenen Immunsystems. Lysozyme, Wasserstoffperoxid und Stickstoffmonoxid von Makrophagen wirken antibakteriell und töten die phagozytierten Bakterien.
4. Aktivierte Makrophagen sezernieren auch eine Vielzahl von Produkten (Tabelle 4.4), von denen viele bei Entzündungen aktiv sind. Viele dieser Produkte sind vorteilhaft; Wenn die Aktivierung der Makrophagen jedoch nicht reguliert wird, haben diese Produkte eine schädigende Wirkung auf das Wirtsgewebe.
5. Makrophagen helfen bei der Verhinderung der Ausbreitung von Krebszellen von einem Ort zum anderen.
6. Makrophagen entfernen alte, beschädigte und sterbende Körperzellen.
7. Makrophagen werden für die Gewebereparatur und Narbenbildung (nach Gewebeverletzung) benötigt
8. Makrophagen scheiden viele Zytokine aus, die das Wachstum und die Aktivität vieler anderer Zellen beeinflussen.
Aktivierte Makrophagen:
Normalerweise befinden sich die Makrophagen im Ruhezustand. Makrophagen werden durch eine Reihe von Reizen aktiviert. Die Makrophagen werden durch Phagozytose von Fremdstoffen wie Bakterien aktiviert. Die Makrophagenaktivität wird durch Cytokine, die von aktivierten T-Helferzellen (wie Interferon-Gamma) ausgeschieden werden, weiter erhöht.
Die aktivierten Makrophagen unterscheiden sich in vielerlei Hinsicht von den ruhenden Makrophagen:
ich. Aktivierte Makrophagen haben eine größere phagozytische Aktivität.
ii. Aktivierte Makrophagen können Mikroben besser abtöten.
iii. Aktivierte Makrophagen produzieren viele Zytokine, die gegen intrazelluläre Bakterien, virusinfizierte Zellen und Krebszellen wirken.
iv. Aktivierte Makrophagen exprimieren auf ihrer Oberfläche sehr hohe MHC-Klasse-II-Moleküle. Folglich erhöht sich ihre Antigen-präsentierende Fähigkeit, T-Zellen zu unterstützen. Makrophagen erleichtern somit die Funktion der Helfer-T-Zellen, und wiederum erleichtern T-Helferzellen die Makrophagenfunktionen.

3. Neutrophile:
Neutrophile werden wegen ihrer neutralen Färbung mit Wright-Färbung so genannt. Neutrophile werden aufgrund der multiplizierten Natur ihrer Kerne oft als polymorphe Kernzellen (PMNs) bezeichnet. Neutrophile sind die wichtigen Leukozyten, die eine wesentliche Rolle bei der Phagozytose von Bakterien und anderen Fremdstoffen spielen, die in den Körper gelangen.
Neutrophile sind bewegliche Zellen und wandern daher frei in Entzündungsherde. Wo immer das Gewebe verletzt wird, reichern sich die Neutrophilen innerhalb weniger Stunden in großer Zahl an der verletzten Stelle an. Neutrophile sind die Hauptphagozyten des angeborenen Immunsystems.
Neutrophile entstehen aus hämatopoetischen Stammzellen im Knochenmark und werden täglich in großer Zahl in den Blutkreislauf freigesetzt (Tabelle 4.5).
Tabelle 4.5: Einige Eigenschaften von Neutrophilen, Lymphozyten und Monozyten-Makrophagen
Neutrophile | Monozyten-Makrophagen | Lymphozyten | |
1. Antigenpräsentation | Nein | Ja | B-Lymphozyten präsentieren Antigen |
T-Lymphozyten zu helfen | T-Lymphozyten zu helfen | ||
2. Primäre Effektorfunktion | Phagozytose | Phagozytose | Variiert zwischen verschiedenen |
Lymphozytengruppen | |||
3. Normaler Hauptstandort | Blut | Alle Gewebe | Lymphgewebe |
4. Immunregulatorische Zytokinproduktion | Nein | Ja | Ja |
Fremdstoffe wie Bakterien werden von Neutrophilen eingeschlossen. Die verschlungenen Bakterien werden dann durch den granularen Inhalt der Neutrophilen abgetötet. Neutrophile erzeugen durch sauerstoffabhängige und sauerstoffunabhängige Mechanismen antimikrobielle Substanzen, um die Mikroben abzutöten.
Ein Erwachsener hat etwa 50 Milliarden Neutrophile im Umlauf. Die Neutrophilen im Blut können sich nicht weiter teilen. Sie haben eine Lebensdauer von 12 Stunden und während dieser Zeit zirkulieren sie im Blut. Wenn die Neutrophilen während ihrer Blutreise auf eine Stelle mit Gewebeverletzung stoßen, verlassen sie den Blutkreislauf und reichern sich in großer Zahl an der verletzten Stelle an.
Am Ort der Gewebeschädigung leben die Neutrophilen nur wenige Stunden. Daher sterben viele Neutrophile an der Stelle einer Gewebeverletzung und frische Neutrophile aus dem Blutkreislauf werden in die Stelle gegossen. Wenn die Neutrophilen sterben, werden die Enzyme aus den Neutrophilen außerhalb der Zelle freigesetzt. Diese Enzyme verflüssigen die nahegelegenen Wirtszellen und das Fremdmaterial, um eine viskose halbflüssige Substanz zu bilden, die Eiter genannt wird.
Der phagozytische Mechanismus von Neutrophilen ähnelt dem von Makrophagen. Reife Neutrophile enthalten mehrere Körnchen. Es wurde beschrieben, dass vier Arten von Granulaten in Neutrophilen vorliegen (Tabelle 4.6).
Tabelle 4.6: Neutrophile Granulate
Primärkörnchen | Sekundärkörnchen | Tertiärkörnchen | Sekretorische Vesikel |
Myeloperoxidase | Lysozym | Gelatinase | Alkalisch |
Phosphatase | Catalase | Phosphatase | |
Lysozym | β2-Mikroglobulin | Cytochrom b558 | |
Elastase | Kollagenase | ||
Cathepsin G | Gelatinase | ||
Proteinasen | Vitamin B12- | ||
Defensins | Bindungsprotein | ||
Kationische Proteine | Lactoferrin | ||
iC3b-Rezeptoren |
1. Primäre (azurophile) Granulate enthalten im Allgemeinen viele antimikrobielle Substanzen. Diese Granula verschmelzen mit dem Phagosom, wodurch die Granula in das Phagolysosom abgebaut werden. Der Inhalt des Granulats wirkt auf die phagozytierten Mikroben und baut sie ab.
ich. Myeloperoxidase im Primärgranulat katalysiert die Produktion von Hypochlorit aus Chlorid und Wasserstoffperoxid durch den oxidativen Stoß.
ii. Defensine töten eine Vielzahl von Bakterien, Viren und Pilzen.
iii. Lysozyme bauen bakterielle Peptidoglykane ab.
2. Sekundäres (spezifisches) Granulat. Einige Sekundärkörnchen verschmelzen auch mit dem Phagosom. Es wird vorgeschlagen, dass die sekundären Körnchen an der Außenseite der Neutrophilen freigesetzt werden und die Entzündungsreaktionen modifizieren.
3. Tertiärgranulate (Gelatinase) enthalten viele Membranproteine.
4. Sekretionsbläschen.
4. Eosinophile:
Eosinophile färben sich stark mit dem Farbstoff Eosin. Eosinophile sind stark mit allergischen Reaktionen und entzündlichen parasitären Infektionen assoziiert. Eosinophil ist ein Leukozyt, der aus hämatopoetischen Stammzellen im Knochenmark produziert wird. Es hat einen Durchmesser von 12-17 um und hat einen zweilappigen Kern.
Das Zytoplasma hat eosinophile Körnchen. 1 bis 3 Prozent der zirkulierenden peripheren weißen Blutkörperchen sind Eosinophile. Die meisten Eosinophilen befinden sich im Bindegewebe, das im gesamten menschlichen Körper vorhanden ist. Zirkulierende Eosinophile haben eine Halbwertszeit von 6 bis 12 Stunden. In den Bindegeweben beträgt die Verweildauer von Eosinophilen nur wenige Tage.
Die Zahl der zirkulierenden Eosinophilen nimmt bei allergischen Erkrankungen und bei Helmintheninfektionen zu. Eosinophilie ist der Begriff, der verwendet wird, um eine solche erhöhte Anzahl von Eosinophilen im peripheren Blut zu bezeichnen. Es wird angenommen, dass Interleukin-5 (IL-5) für den Anstieg der Eosinophilen unter diesen Bedingungen verantwortlich ist.
5. Basopliils:
Basophile (Durchmesser 7-10 µm) zirkulieren weiße Blutkörperchen, die von hämatopoetischen Stammzellen im Knochenmark stammen.
Basophile haben viele Eigenschaften von Gewebemastzellen. Wie Mastzellen verfügen Basophile über Membranrezeptoren für die Fc-Region von IgE (in jeder Zelle sind etwa 70.000 Rezeptoren vorhanden) und das Cytoplasma enthält histaminreiche Granula. Es gibt jedoch viele morphologische und biochemische Unterschiede zwischen Basophilen und Mastzellen.
Basophile sammeln sich während vieler entzündlicher Zustände im Gewebe an. Es wird allgemein angenommen, dass Basophile an IgE-vermittelten Reaktionen teilnehmen, ähnlich wie bei Mastzellen. Die Rolle der Basophilen bei Immunität und Überempfindlichkeit ist jedoch noch nicht bekannt.


